Nature https://www.nature.com/articles/s41392-020-00352-y
L’urgente necessità di combattere il COVID-19, ha accelerato lo sviluppo dei diversi tipi di vaccini SARS-CoV-2 tra i quali i vaccini inattivati, i vaccini basati su acidi nucleici, i vaccini vettoriali a base di adenovirus e i vaccini con sub-unità ricombinanti.
Due vaccini stanno dominando la scena,
Pfizer che ha annunciato il vaccino a base di mRNA, BNT162b2, messo a punto in collaborazione con la tedesca BioNTech con un’efficacia del 90%. Il suo studio è ancora in corso, ma la società americana è pronta a chiedere “l’autorizzazione all’uso di emergenza (EUA)” alla Food and Drug Administration (FDA) Statunitense;
Moderna, il cui direttore Stéphane Bancel dichiara che primi risultati della sperimentazione sul vaccino contro il coronavirus sono ancora più promettenti di quelli annunciati da Pfizer all’inizio di questo mese. Il vaccino Moderna mRNA-1273 sembra essere efficace al 95% e funzionare in coloro che hanno più bisogno di protezione – le persone di età superiore ai 65 anni – ha annunciato oggi la società con sede negli Stati Uniti. Il vaccino può anche essere conservato in un normale congelatore o frigorifero.
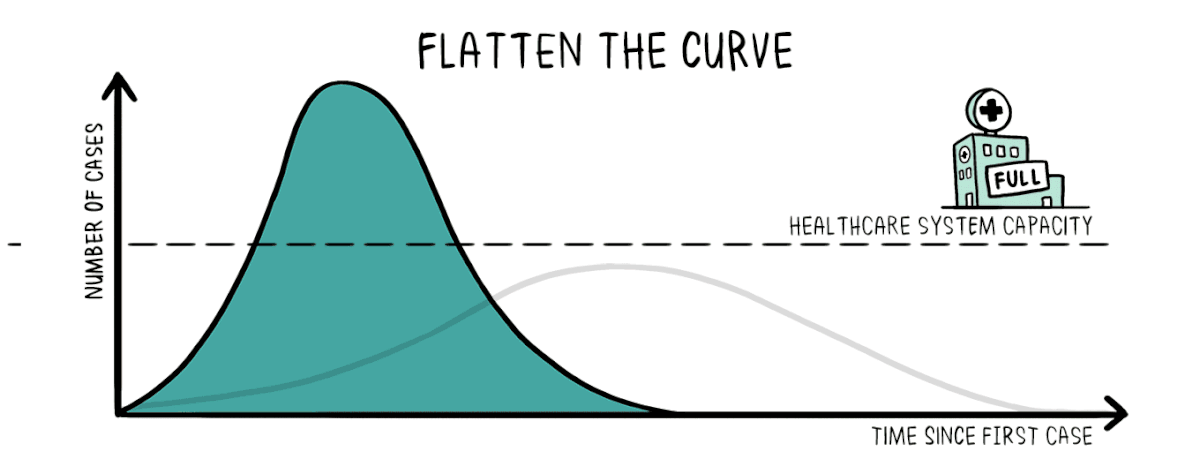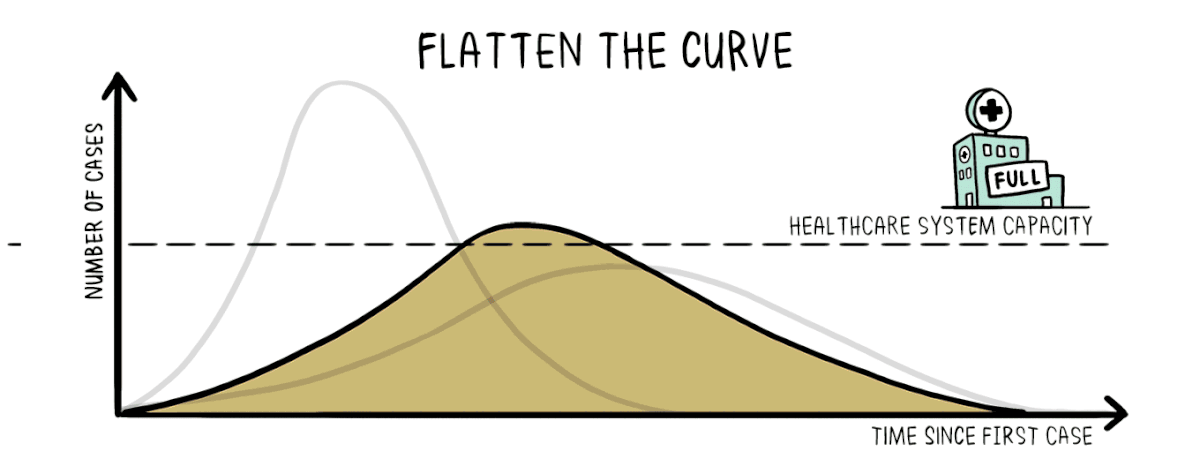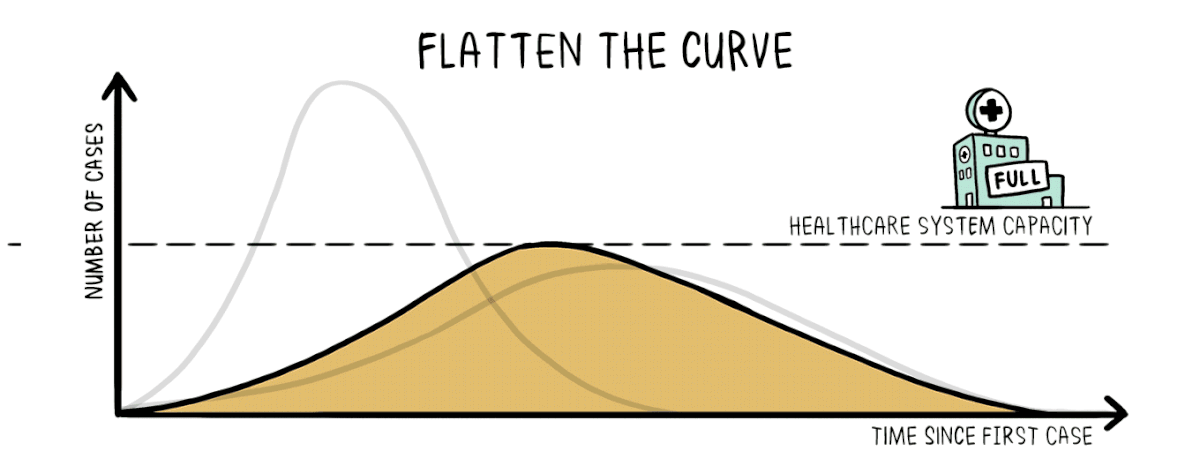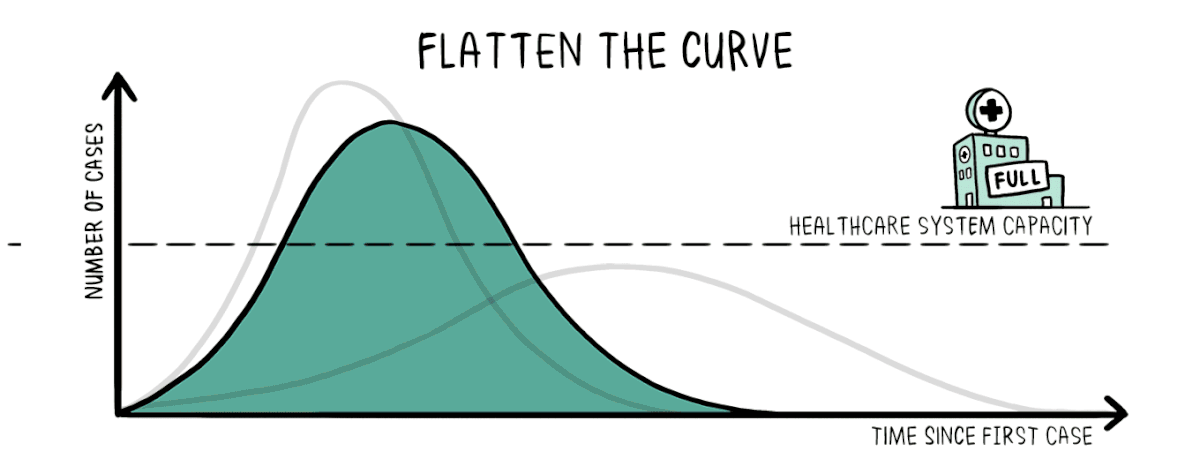
Nonostante i ritmi vertiginosi di sviluppo, la data della disponibilità del vaccino è ancora incerta.
Lo scenario più promettente descritto dal virologo Anthony Fauci, direttore dell’Istituto Nazionale di Allergie e Malattie Infettive US, è quello di vedere un vaccino funzionante alla fine di quest’anno 2020.
Di seguito vengono mostrate le piattaforme potenzialmente usabili per lo sviluppo del vaccino contro il SARS CoV 2.
| PIATTAFORMA | BERSAGLIO | VACCINI AUTORIZZATI ESISTENTI BASATI SULLA STESSA PIATTAFORMA | VANTAGGI | SVANTAGGI |
| Vaccini a RNA | Spike | No | · Non si maneggiano virus infettivi
· Tipicamente immunogenici · Produzione rapida possibile |
Sono stati riportati problemi dovuti a reazioni avverse |
| Vaccini a RNA | Spike | No | · Non si maneggiano virus infettivi
· Tipicamente immunogenici · Produzione rapida possibile |
Sono stati riportati problemi dovuti a reazioni avverse |
| Vaccini basati su proteine ricombinanti | Spike | Sì:
· per influenza, · HBV, HPV (espressione in lievito) |
· Non si maneggiano virus infettivi
· Possono essere usati additivi per potenziarne l’immunogenicità |
· La produzione a livello globale può essere limitata
· L’ integrità degli antigeni e/o epitopi deve essere certa · La resa deve essere abbastanza alta |
| Vaccini basati su vettori virali | Spike | Sì per il VSV (Ervebo)
No per altri vaccini basati su vettori virali |
· Non si maneggiano virus infettivi
· Dati pre-clinici e clinici molto promettenti per diversi nuovi virus emergenti |
L’immunità al vettore può influenzare negativamente quella al vaccino |
| Vaccini attenuati | Virione intero | Sì | · Processo molto ben consolidato per la produzione di diversi vaccini umani
Si possono usare infrastrutture esistenti |
· Creare cloni infettivi per vaccini attenuati contro i coronavirus richiede tempo
I test di sicurezza devono essere numerosi |
| Vaccini inattivati | Virione intero | Sì | · Processo ben consolidato per la produzione di diversi vaccini umani
· Si possono usare infrastrutture esistenti · Sono stati testati negli esseri umani contro il SARS-CoV-1 · Si possono usare additivi per aumentarne l’immunogenicità |
· Necessità di maneggiare grandi quantità di virus infettivo
L’ integrità degli antigeni e/o epitopi deve essere certa |
I vaccini con i virus inattivati sono resi non infettivi tramite degli approcci fisici o chimici e la cui sperimentazione risulta attraente perché presentano più proteine virali per il riconoscimento immunitario. Questi hanno un’espressione stabile di epitopi antigenici dipendenti dalla conformazione e possono essere facilmente prodotti in grandi quantità.
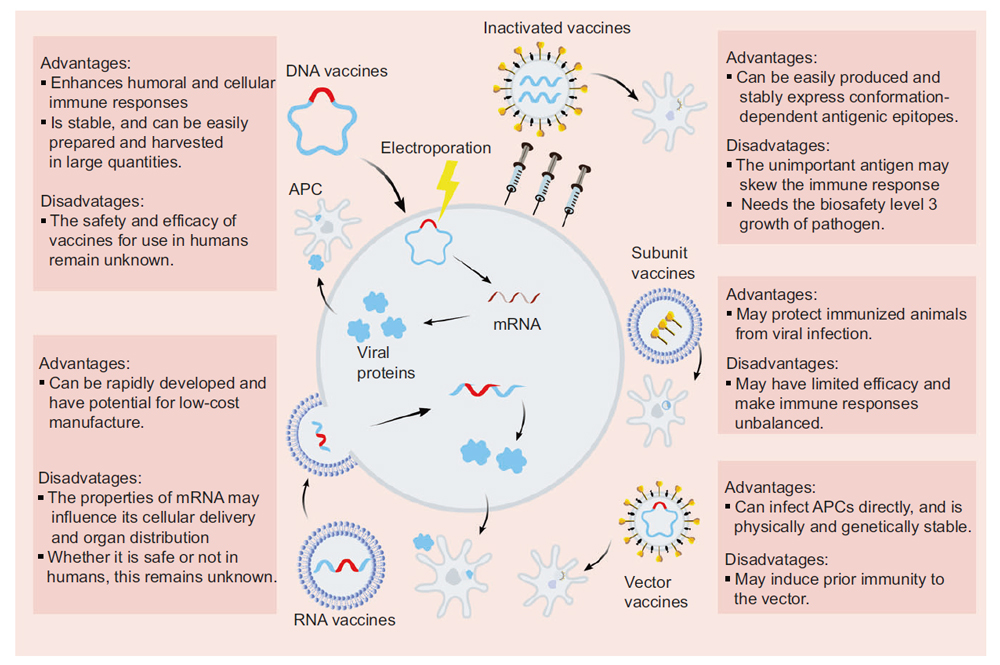

I virus inattivati purificati, tradizionalmente utilizzati per lo sviluppo di vaccini, si sono rivelati efficaci nella prevenzione delle malattie virali, come l’influenza. Il vaccino SARS-CoV-2 inattivato, BBIBP-CorV, ha dimostrato potenza e sicurezza in modelli animali; pertanto, si prevede che sarà sottoposto a ulteriori test negli studi clinici.
Un altro studio di valutazione di un vaccino candidato contro il virus SARS-CoV-2 inattivato purificato, PiCoVacc, ha mostrato l’induzione di NAb contro SARS-CoV-2 in topi, ratti e macachi rhesus con nessun cambiamento o patologia delle citochine osservati nei macachi.
Il vaccino inattivato SARS-CoV-2 contenente idrossido di alluminio, sviluppato da Sinovac è entrato negli studi clinici di fase 3, con i risultati dello studio di fase 2 che dimostrano che due dosi di 6 μg / 0,5 ml o 3 μg / 0,5ml del vaccino sono stati ben tollerati e immunogenici negli adulti sani.
I risultati dello studio di fase 2, del vaccino SARS-CoV-2 inattivato, costruito dal Wuhan Institute of Biological Products e Sinopharm, hanno riportato che la media geometrica dei titoli (GMT) del NAb erano 121 e 247 al giorno 14 dopo 2 iniezioni nei partecipanti che ricevevano il vaccino rispettivamente nei giorni 0 e 14 e nei giorni 0 e 21, mostrando solo reazioni avverse transitorie e auto-limitanti.
Di seguito viene descritto lo sviluppo dei vaccini che si trovano, ora , nella fase 3.
| LO SVILUPPO DI VACCINI CANDIDATI, NELLA FASE 3 DELLA FASE CLINICA | ||||||
TIPO DI VACCINO |
VACCINO |
SVILUPPATORE |
FASE CLINICA |
N DOSI |
TEMPO DEL DOSAGGIO |
RISULTATI DELLE PROVE CLINICHE |
VACCINI INATTIVATI |
The inactivated SARS-CoV-2 |
Sinovac |
Fase 3 |
2 |
0-14 giorni |
Lo studio in fase 2 ha mostrato che due dosi di 6μg / 0,5 mL o 3μg / 0,5 ml del vaccino erano ben tollerate e immunogeniche negli adulti sani, con una dose di 3μg che provocava una sieroconversione del 92,4% durante i giorni 0, 14 e del 97,4% sotto i giorni 0, 28 programma. |
|
|
The inactivated |
Wuhan Institute of Biological Products/Sinopharm |
Fase 3 |
2 |
0-14 giorni0-21 giorni |
Lo studio in fase 2 ha mostrato che i GMT di NAbs erano 121 e 247 al giorno 14 dopo 2 iniezioni nei partecipanti che ricevevano il vaccino rispettivamente nei giorni 0 e 14 e nei giorni 0 e 21. Inoltre, reazioni avverse di 7 giorni si sono verificate nel 6,0% e nel 19,0% dei partecipanti che hanno ricevuto iniezioni nei giorni 0 e 14 rispetto ai giorni 0 e 21. |
|
|
The inactivated |
Beijing Institute of Biological Products/Sinopharm |
Fase 3 |
2 |
0-14 giorni0-21 giorni |
N/A |
VACCINI RNA |
BNT162b1 |
Pfizer/Fosun Pharma/BioNTech |
Fase 3 |
2 |
0-28 giorni |
Lo studio in fase 1/2 ha mostrato che il vaccino ha causato sintomi locali e sistematici da lievi a moderati nella maggior parte dei vaccinatori e i titoli neutralizzanti la media geometrica dopo la dose di 10 e 30 μg 2 hanno raggiunto da 1,8 a 2,8 volte quello del pannello di sieri convalescenti COVID-19. |
|
|
mRNA-1273 |
Moderna/NIAID |
Fase 3 |
2 |
0-28 giorni |
Lo studio in fase 1 ha riportato che la serie di vaccini a due dosi non era seriamente tossica e poteva suscitare risposte di cellule T CD4 + polarizzate NAb e Th1. |
VACCINI A VETTORI NON REPLICANTI |
Adenovirus Type 5 Vector |
CanSino Biological Inc./Beijing Institute of Biotechnology |
Fase 3 |
2 |
N/A |
Lo studio in fase 2 ha mostrato che il vaccino a una dose di 5 × 1010 particelle virali per mL era più sicuro del vaccino a 1 × 10¹¹ particelle virali e ha suscitato una risposta immunitaria comparabile ad esso. Tuttavia, l’elevata immunità Ad5 preesistente ha ridotto la risposta ai NAbs e ha influenzato la risposta immunitaria dei linfociti T. |
|
|
ChAdOx1 nCoV-19 |
University of Oxford/AstraZeneca |
Fase 3 |
2 |
N/A |
Lo studio in fase 1/2 ha riportato che le risposte NAb sono state rilevate nel 91% dei partecipanti dopo una singola dose quando misurata in MNA80 e nel 100% dei partecipanti quando misurata in PRNT50. Dopo una dose di richiamo, tutti i partecipanti hanno svolto un’attività neutralizzante. Le reazioni locali e sistemiche, inclusi dolore, febbre e dolori muscolari, potrebbero essere ridotte dal paracetamolo. |
|
|
Adeno-based (rAd26-S + rAd5-S) |
Gamaleya Research Institute |
Fase 3 |
2 |
0-21 giorni |
Lo studio in fase 1/2 ha mostrato che la somministrazione di rAd26-S e rAd5-S ha causato la produzione di NAbs nel 100% dei partecipanti al giorno 42 per entrambe le formulazioni di vaccino liofilizzato e congelato. Le risposte immunitarie cellulari sono state rilevate in tutti i partecipanti al giorno 28. Inoltre, la risposta immunitaria preesistente ai vettori rAd26 e rAd5 non ha influenzato il titolo degli anticorpi RBD-specifici. |
|
|
Ad26COVS1 |
Janssen Pharmaceutical Companies |
Fase 3 |
2 |
0-56 giorni |
Studi preclinici hanno dimostrato che una singola immunizzazione con un vettore Ad26 che codifica per un antigene S stabilizzato in prefusione ha innescato risposte NAb robuste e ha fornito una protezione completa o quasi completa nei macachi rhesus. L’immunogeno contiene la sequenza leader di tipo selvatico, la S legata alla membrana a tutta lunghezza, la mutazione del sito di scissione della furina e due mutazioni stabilizzatrici della prolina. |
I virologi dichiarano che ci sono buone probabilità che entro la fine dell’anno si abbiano 2 vaccini contro il Covid-19, approvati con autorizzazione di emergenza dalla Food and Drug Administration (Fda).